Ученые создали наночастицы, сберегающие здоровые клетки при лучевой терапии
Модифицированные биоактивным веществом наночастицы на основе оксида церия, способные при воздействии рентгеновских лучей на раковую опухоль избирательно защищать окружающие здоровые клетки от гибели, синтезировали российские ученые, 18 декабря сообщили «Известия».
Эти наночастицы, созданные научным коллективом ученых из Института теоретической и экспериментальной биофизики (ИТЭБ) РАН и Саратовского национального исследовательского государственного университета им. Н. Г. Чернышевского, поддерживают работу антиоксидантных систем нормальных клеток, защищая их таким образом от рентгеновского излучения, а у раковых, напротив, стимулируют выработку активных форм кислорода, повреждающих их клеточные структуры.
Такой эффект, полагают ученые, является результатом того, что кислотность раковых клеток иная, чем у здоровых. Поэтому созданные наночастицы могут быть использованы при лечении онкологических заболеваний для уменьшения вредного воздействия лучевой терапии на здоровые клетки.
В процессе лучевой терапии раковую опухоль уничтожают рентгеновским, гамма- или другим ионизирующим излучением. При этом в клетках запускаются окислительные процессы, повреждающие клеточные структуры, и клетки гибнут. Но гибнут не только раковые, но и здоровые клетки организма, на которые воздействует излучение, что ухудшает состояние организма пациента.
Решая задачу поиска новых антиоксидантов и радиопротекторов, способных нейтрализовать окислительный стресс и в идеале обладать селективной окислительно-восстановительной активностью, команда исследователей обратилась к наночастицам на основе оксида церия, являющегося биосовместимым соединением, вступающем в большое количество окислительно-восстановительных реакций.
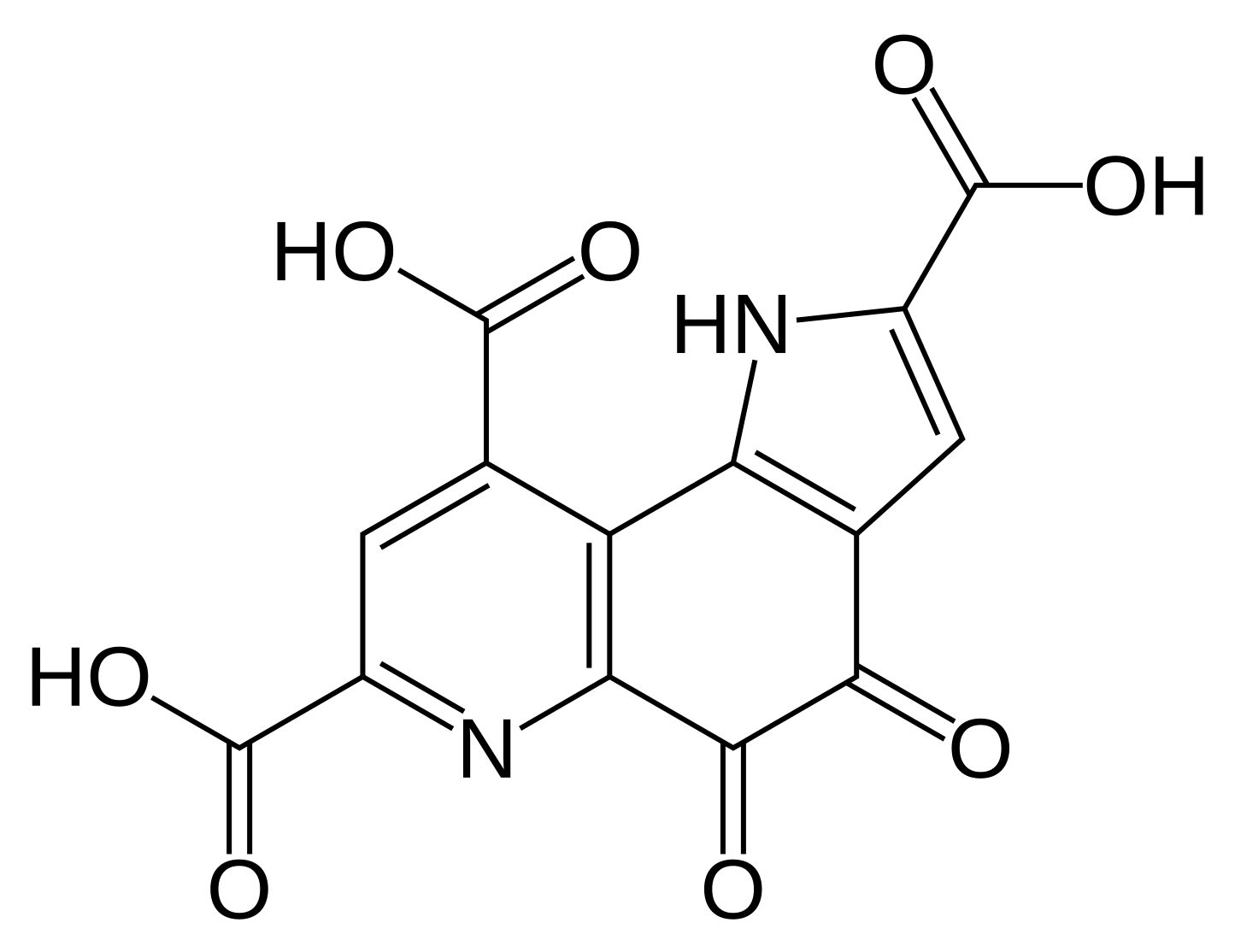
Оксид церия может защищать здоровые клетки от повреждений во время лучевой терапии и одновременно усиливать повреждения ДНК в раковых клетках. Чтобы повысить избирательность оксида церия, ученые модифицировали его пирролохинолинхиноном, называемым также витамином B14 или метоксатином, который обладает высоким антиоксидантным эффектом и участвует в регуляции работы митохондрий, энергетических «станций» клетки.
Для проверки действия полученных наночастиц они наносили несколько разных концентраций этих частиц на здоровые клетки соединительной ткани (фибробласты) мыши и на раковые клетки. Таким образом исследователи определили концентрации, не вызывавшие массовой гибели ни одного из типов клеток, и использовали такие концентрации в экспериментах с рентгеновским излучением.
На этом втором этапе исследования, до обработки образцов наночастицами, ученые установили, что рентгеновские лучи снижают жизнеспособность фибробластов на 75%, а раковых клеток — на 32%. Однако после обработки и последующего облучения выживаемость здоровых фибробластов возросла на 45% по сравнению с контрольными клетками, которые не обрабатывали наночастицами и не облучали, а гибли они в небольшом количестве по естественным причинам.
Выживаемость опухолевых клеток, обработанных наночастицами, снизилась на 31–37% по сравнению с контрольной группой. Такое избирательное токсичное действие в отношении раковых клеток, считают участники исследования, вызывается повышенной у них, относительно здоровых клеток, кислотностью среды, которая изменяет свойства наночастиц, снижая их антиоксидантную эффективность.
Результаты исследования были представлены в статье «Новые наночастицы оксида церия, модифицированные пирролохинолинхиноном, и их селективная цитотоксичность при рентгеновском облучении» (Novel Pyrroloquinoline Quinone-Modified Cerium Oxide Nanoparticles and Their Selective Cytotoxicity Under X-Ray Irradiation), опубликованной в журнале Antioxidants.
Руководитель проекта, заведующая лабораторией изотопных исследований ИТЭБ РАН кандидат биологических наук Нелли Попова сообщила: «В дальнейшем мы планируем провести эксперименты на других типах здоровых и раковых клеток, чтобы лучше понять, как в каждом случае работают наночастицы».
Заместитель руководителя рабочей группы НТИ HealthNet по направлению «Биомедицина», научный консультант АО «Р-Фарм» Андрей Ломоносов считает, что применение разработанных наночастиц для усиления воздействия ионизирующего излучения при лечении онкологических заболеваний, особенно неоперабельных опухолей и метастазов, очень перспективное направление, которое в последнее десятилетие активно развивается.
«Проект за счет снижения общей радиационной нагрузки на пациента может открыть возможность для эффективной терапии онкологических заболеваний тем пациентам, для которых высокая лучевая нагрузка противопоказана», — указал научный консультант.
Заведующий лабораторией молекулярного моделирования Центра компетенций НТИ «Цифровое материаловедение: новые материалы и вещества» МГТУ им. Н. Э. Баумана Евгений Александров отметил, что перед использованием на практике разработчикам придется провести весь необходимый комплекс исследований, в том числе на живых организмах. При этом ускорить этот процесс может понимание механизмов воздействия лекарства на молекулярном уровне.
Эксперт рынка НТИ «Хелснет», заведующий кафедрой онкологии Самарского государственного медицинского университета, профессор Олег Каганов также подтвердил, что разработка нового противоракового средства потенциально перспективна, но для окончательных выводов необходимы дополнительные исследования.
























