Ученые продвинулись в поисках метода лечения болезни Хантингтона
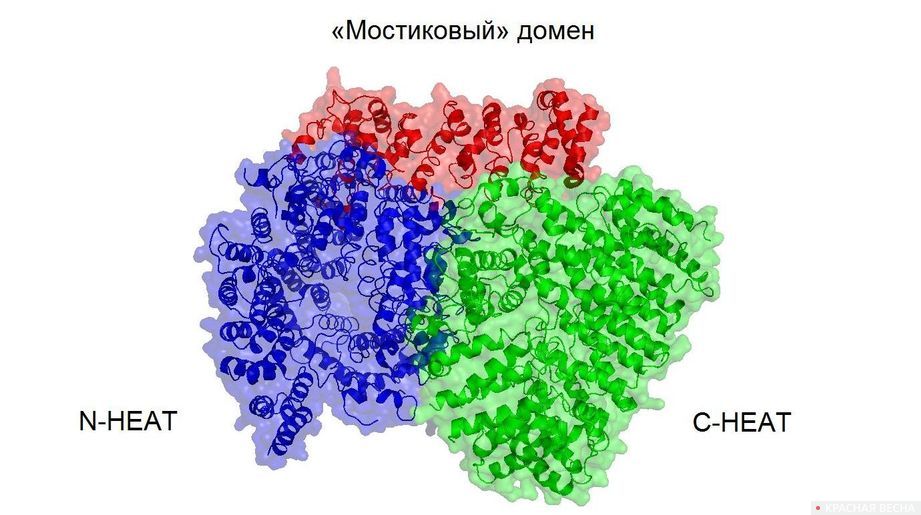
Пространственную структуру белка хантингтина удалось выяснить коллективу немецких ученых, 1 марта сообщает корреспондент ИА Красная Весна.
Статья с детальным описанием открытия опубликована в рецензируемом научном журнале Nature. Исследователи выделили белок хантингтин (HTT) в комплексе c белком HAP40 из клеточной линии HEK293, продуцирующей оба этих белка. Комплекс был закристаллизован в виде глобулы размером 120×80×100 Å (1 Å (ангстрем) = 10-10 м — прим. ИА Красная Весна). Пространственная структура продукта кристаллизации была определена c разрешением 4 Å методом криоэлектронной микроскопии. По микрофотографии ученые восстановили координаты всех атомов, входящих в структуру как самого хантингтина, так и HAP40.
Подтвердилось, что хантингтин состоит из трех доменов (независимых элементов структуры — прим. ИА Красная Весна). Концевые домены (N-HEAT и C-HEAT) идентичны по структуре и состоят из так называемых HEAT-повторов, которые упакованы по «катушечному» (α-соленоидальному) принципу. В пределах N-HEAT-домена найдены два участка, за счет которых хантингтин «крепится» к мембране клеток. N-HEAT- и C-HEAT-домены соединены гибким «мостиковым» доменом, что позволяет им сдвигаться друг относительно друга. Такое строение хантингтина позволяет ему изящно «подстраиваться» под взаимодействие с белками-партнерами — например, всё c тем же HAP40.
Отметим, что белок хантингтин выполняет в человеческом организме множество взаимосвязанных функций, опосредуя многие белок-белковые взамодействия. Известно, что хантингтин взаимодействует в головном мозгу как минимум с 747 различными белками. Однако конкретная роль этого белка пока неизвестна.
Несмотря на то, что аминокислотная последовательность хантингтина известна с 1995 года, его пространственная структура по сей день оставалась неизвестной. Предыдущие попытки разрешить эту структуру проваливались по двум причинам. Во-первых, некоторые ее участки слишком подвижны для кристаллизации. Во-вторых, отдельные молекулы хантингтина склонны к агрегации (слипанию) друг с другом.
В отсутствии белка-«помощника» удавалось охарактеризовать только небольшой (первые 17 аминокислотных остатков) концевой фрагмент белка, в то время как структура остальных 97% белковой цепи оставалось неизвестной. Целиком определить пространственную структуру хантингтина удалось только в комплексе с одним из его естественных партнеров — белком HAP40.
Отметим также, что с врожденной мутацией гена, кодирующего хантингтин, связана болезнь Хантингтона. Мутантный белок несет на одном из своих концов (N-конце) множество остатков глутамина (одна из аминокислот — прим. ИА Красная Весна), которых нет в нормальном белке.
Болезнь Хантингтона — это нейродегенеративное заболевание, дебют которого приходится на 30–50 лет. Оно связано с прогрессирующей гибелью нейронов полосатого тела (стриатума) в головном мозгу, что проявляется в виде так называемой хореи — беспорядочных неконтролируемых движений. На поздних стадиях болезни человек полностью теряет контроль над мышечной активностью и речью. Со временем может поражаться и кора головного мозга. В таких случаях к двигательным расстройствам присоединяются когнитивные нарушения — в первую очередь деградация абстрактного мышления. Ни одного лекарства против болезни Хантингтона пока что не изобретено.
Напомним, болезнь Хантингтона — генетически обусловленное заболевание, что создает исключительные трудности при разработке лекарства против нее. До сих пор ученым оставалось только приближать момент, когда технологии редактирования генома разовьются настолько, что мутантный ген можно будет вырезать из ДНК пацента «генетическими ножницами». Теперь же, когда стала известна структура хантингтина, могут открыться и другие — пока что легче реализуемые — способы борьбы с этим недугом.

















