Ученые США резко продвинулись в понимании происхождения рака кишечника
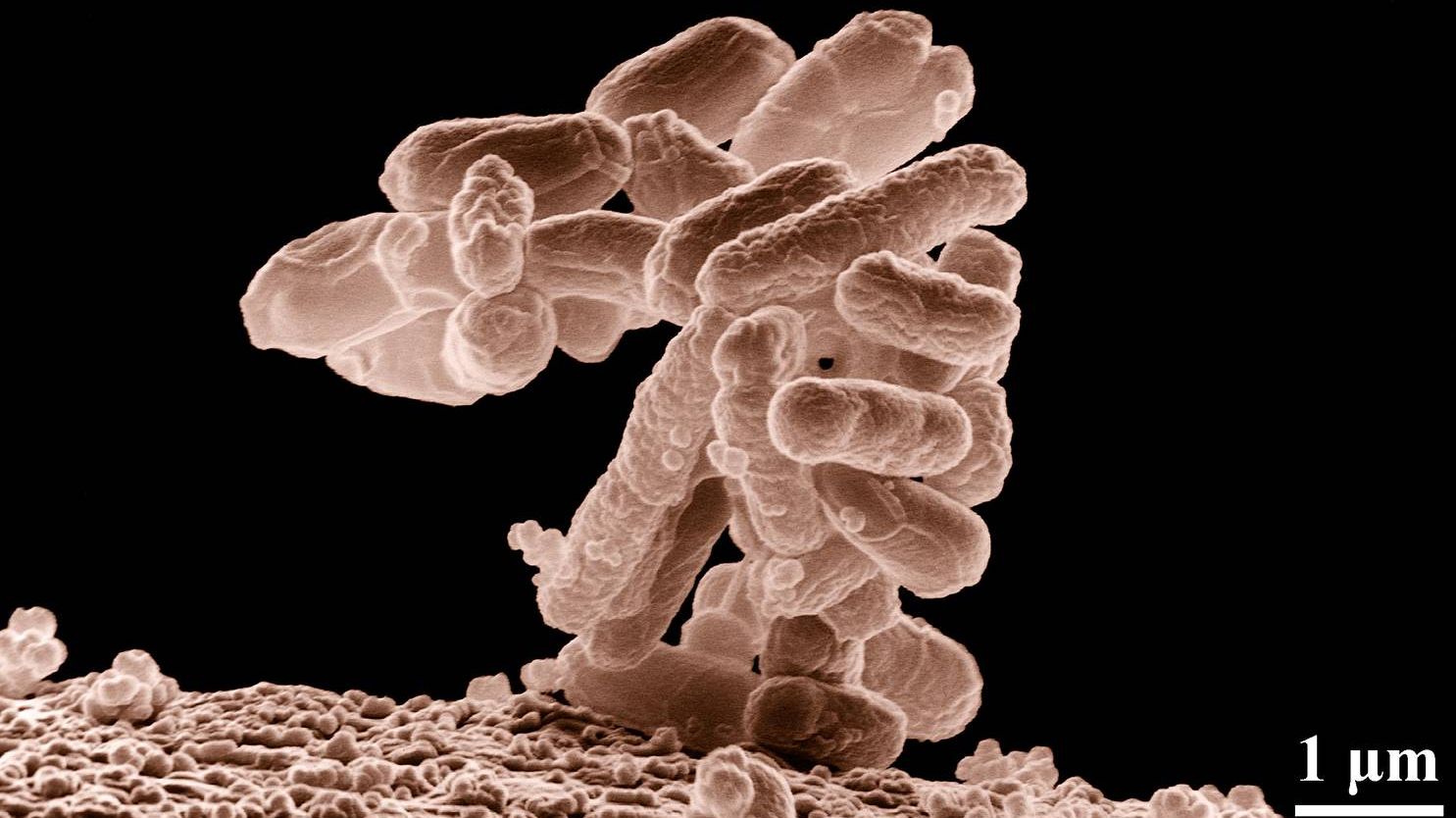
В способности одного из токсинов кишечной палочки (Escherichia coli) повреждать ДНК человека и тем самым вызывать рак удостоверились американские ученые из Университета Северной Каролины в Чапел-Хилл, 16 февраля сообщает журнал Science.
Ученые использовали в своих исследованиях специальный штамм E. coli, в геноме которого присутствует pks-островок — специальная группа генов, кодирующих несколько ферментов. Эти ферменты отвечают за синтез колибактина — бактериального токсина, который обладает онкогенными свойствами.
В самом деле, с 2012 года известно, что такие штаммы (pks+-штаммы) преобладают в кишечной микрофлоре при колоректальном раке (раке кишечника). Их вовлеченность в рост злокачественных опухолей подтверждена также исследованиями на мышиных моделях этого заболевания.
Что же касается самого колибактина и его роли в развитии недуга, то существует предположение, что этот токсин алкилирует ДНК по азотистым основаниям, присоединяясь к ним через один из своих атомов углерода. Поврежденные ДНК-фрагменты требуют репарации («починки»), которая проходит не без ошибок и зачастую приводит к мутациям отдельных нуклеотидов (структурно-информационных звеньев ДНК). Когда такие мутации затрагивают так называемые онкогены, это с высокой вероятностью может запустить опухолевый процесс.
Американские ученые сосредоточились на доказательстве именно этой гипотезы. Они выделили из мышиных и человеческих клеток, зараженных pks+-штаммами E. coli, поврежденные фрагменты ДНК. При анализе этих повреждений была выявлено, что ключевую роль в алкилировании азотистых оснований играет циклопропановое кольцо (цикл из трех атомов углерода) — один из структурных элементов колибактина.
Оно служит своеобразной «боеголовкой» (англ. warhead), которая атакует остатки аденина (одно из 4-х азотистых оснований в ДНК) по 3-му атому азота (N3). Алкилирование происходит с размыканием циклопропанового кольца, чему способствует сильное пространственное напряжение в трехчленном углеродном цикле.
Ученые также восстановили по продуктам алкилирования структурную формулу колибактина. Впрочем, они предполагают, что активная форма токсина («пре-колибактин»), непосредственно атакующая остатки аденина в ДНК, имеет другую, более сложную структуру, которую не удается непосредственно зафиксировать из-за ее малой стабильности.
Отметим, колоректальный рак представляет собой злокачественную опухоль толстой кишки. К факторам риска, помимо курения и употребления жирной пищи, относится бесконтрольное применение антибиотиков в молодом возрасте. Предполагается, что антибиотики, нарушая баланс кишечной микрофлоры, способствует ее обогащению патогенными, в том числе и pks+-штаммами E. coli.
Колоректальный рак, как правило, трудно обнаружить на ранних стадиях, поэтому большинство пациентов, которым ставят этот диагноз, сталкиваются с неблагоприятным прогнозом. Выживаемость таких больных в течение одного года в среднем составляет лишь около 40%.
Отметим также, состав кишечной микрофлоры влияет на организм животных и человека крайне многообразно. Так, на примере дрозофил ранее было показано, что один из видов бактерий, живущих в кишечнике этих плодовых мушек, может влиять на их поведение за счет выделения специального белка.
Читайте также: Бактерии играют на нервах: кишечная микрофлора влияет на поведение дрозофил
Исследование американских ученых свидетельствует, что пока мы видим лишь вершину айсберга под названием «кишечная микрофлора». В самом деле, если человеческий геном насчитывает около 20 000 генов, то микроорганизмы из нашего кишечника в сумме содержат в 100–150 раз больше генетического материала, причем едва ли не каждому из этих 2–3 миллионов ДНК-фрагментов соответствует свой белковый продукт.
Очевидно, что значительная часть этих белков не может не влиять тем или иным образом на организм человека. Если вообразить себе такое влияние во всем многообразии, то станет понятно, что мы находимся едва ли не под бόльшим управлением бактериальных генов, нежели своих собственных.
В этой связи правы те ученые, которые считают, что медицина будущего должна в первую очередь научиться управлять составом кишечной микрофлоры. В самом деле, крайне вероятным представляется тот факт, что многие тяжелые болезни, включая неизлечимые на сегодняшний день, провоцируются разбалансировкой этой «внутренней экосистемы».
















