Ученые научились бороться с устойчивыми к антибиотикам бактериями туберкулеза
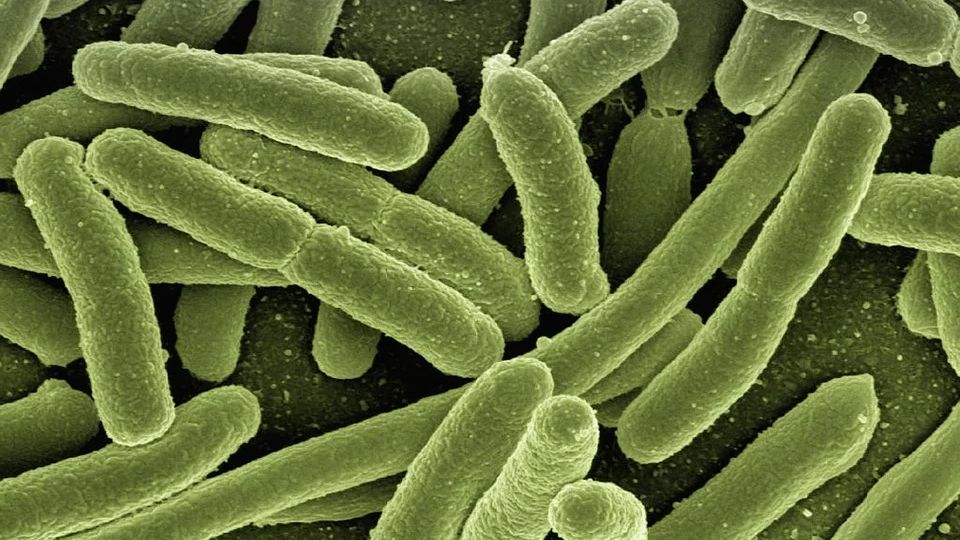
Исследование, доказавшее, что облучение желтым светом с длиной волны 565 нанометров убивает микобактерии туберкулеза, в том числе «спящие», провели ученые из Федерального исследовательского центра «Фундаментальные основы биотехнологии» (ФИЦ Биотехнологии) РАН и Центрального научно-исследовательского института туберкулеза (ЦНИИТ). 6 марта об этом сообщил портал «Научная Россия» со ссылкой на пресс-службу РНФ.
Такой способ борьбы с возбудителем туберкулеза возможен, потому что покоящиеся клетки Mycobacterium tuberculosis синтезируют и накапливают большое количество азотсодержащих пигментов — порфиринов, соединений, высокочувствительных к свету. При его воздействии порфирины генерируют активные формы кислорода, которые повреждают белки и ДНК бактерий.
Предложенный метод может быть применен против лекарственно-устойчивых и «спящих» форм микобактерий. Неактивные патогены резистентны ко всем известным антибиотикам, часто сохраняются в легких пациентов после лечения и могут в дальнейшем (в 5–10% случаев) вызывать рецидивы заболевания. Кроме того, «пробуждение» микобактерий нередко вызывается заболеванием COVID-19.
Проведенные эксперименты показали, что желтый свет за 30 минут облучения способен уничтожить 99,99% бактерий. Результаты исследования ученые представили в статье «Приобретение светочувствительности микобактериями туберкулеза in vitro и внутри инфицированных макрофагов связано с накоплением эндогенных Zn-порфиринов», опубликованной в журнале Scientific Reports.
Туберкулез — опасное инфекционное заболевание вызывается грамположительной бактерией Mycobacterium tuberculosis, которая обладает устойчивостью ко многим современным антибиотикам и потому очень плохо поддается лечению. Это вынуждает ученых искать другие, нетрадиционные методы лечения туберкулеза.
Обратившись к тогда еще гипотетической возможности борьбы с M. tuberculosis, исследователи в лаборатории получили ее покоящиеся формы и измерили количество порфиринов в клетках. Выяснилось, что количество молекул порфиринов в них в шесть раз выше, чем в активных бактериях.
Добавка в среду́, на которой росли M. tuberculosis, 5-аминолевулиновой кислоты (вещество — предшественник порфиринов) привело к 85-кратному росту количества порфиринов в покоящихся клетках.
Далее, получив экстракты из клеток Mycobacterium tuberculosis, исследователи определили длины волн, при которых порфирины в растворе поглощают максимальное количество света. Ученые остановились на свете с длиной волны 565 нанометров (желтый), к которому были наиболее чувствительны молекулы порфирина цинка (Zn-порфирины).
В результате 30-минутного облучения культуры микобактерий светом с такой длиной волны 99,99% патогенов погибло. Такой результат не давал ни один антибиотик, даже в случае активно растущих микобактерий.
Авторы статьи объясняют этот феномен тем, что активные формы кислорода, выработанные порфиринами на свету, разрушили у бактерий дыхательную цепь — комплекс белков, которые организуют обеспечение клеток энергией.
Однако такое же воздействие на активные формы бактерий не оказало желаемого эффекта, поскольку они практически не накапливают порфирины. Тогда исследователи придумали способ, который стимулировал накопление порфиринов и в спящих, и в активно размножающихся микобактериях.
Ученые стали предварительно обрабатывать клетки 5-аминолевулиновой кислотой, безопасной для человека и уже используемой при диагностике рака. Пациенты смогут его принимать, просто запивая водой.
Для моделирования реальных условий заболевания авторы поставили такой же эксперимент на активно размножающихся и «спящих» бактериях, поглощенных макрофагами, защищающими организм человека от болезнетворных микроорганизмов.
Выдерживание макрофагов с микобактериями в среде с 5-аминолевулиновой кислотой привело к тому, что эти «съеденные», но не разрушенные макрофагами микобактерии оказались более чувствительными к свету, чем даже свободные микобактерии, — как «спящие», так и активные. Ученые объясняют это тем, что внутриклеточная среда макрофагов снижает устойчивость M. tuberculosis к дополнительным разрушающим воздействиям.
В клинической практике новый метод лечения туберкулеза можно обеспечить с помощью световодов, которые доставят свет нужной длины волны в очаги заболевания. Например, таким световодом может служить волоконно-оптический бронхоскоп, с помощью которого врач исследует очаги туберкулеза в легких. Другим вариантом могут стать гибкие органические светоизлучающие диоды, используемые как источники света нужной длины волны.
Заведующая лабораторией биохимии стрессов микроорганизмов ФИЦ Биотехнологии РАН, доктор биологических наук Маргарита Шлеева, руководитель проекта, рассказала о проделанной в его рамках работе:
«Эксперименты доказали, что эффективность предложенного подхода достигает 99,99%, поэтому потенциально его можно будет использовать в клинической практике для уничтожения как неактивных очагов туберкулеза в легких человека, так и возбудителя туберкулеза с множественной лекарственной устойчивостью. Однако нам еще предстоит проверить этот метод на лабораторных животных».












