«Овладели силой эволюции»: названы лауреаты Нобелевской премии по химии
Обнародованы имена ученых, которым присуждена Нобелевская премия по химии за 2018 год, 3 октября сообщает пресс-служба Нобелевского комитета в Twitter.
Ими стали Фрэнсис Арнольд (США), Джордж Смит (США) и Грегори Винтер (Великобритания).
Американка Фрэнсис Арнольд удостоилась награды за «направленную эволюцию» белковых ферментов — естественных катализаторов, без которых невозможна ни одна химическая реакция в нашем организме. Ученая нашла способ направленно улучшать их эффективность, шаг за шагом отбирая самые активные соединения из молекулярных библиотек. В каком-то смысле Арнольд применила к отдельным молекулам принципы естественного отбора, действующие в природном макромире. По словам Нобелевского комитета, ей вместе с коллегами удалось «овладеть силой эволюции».
Ее соотечественник Джордж Смит известен тем, что в 1985 году предложил технологию фагового дисплея. Этот изящный метод позволяет подбирать антитела практически к любым белкам с помощью фагов — специальных вирусов, поражающих бактерии. Для фагового дисплея нужна библиотека генов, кодирующих всевозможные варианты человеческих антител (иммуноглобулинов). После встраивания этой библиотеки в геном вируса соответствующие иммуноглобулины отображаются на фаговой оболочке, после чего остается отобрать те из них, которые свяжутся с белком-мишенью. Чтобы достичь нужной степени «обогащения», процедуру повторяют несколько раз, как и при «эволюции» ферментов.
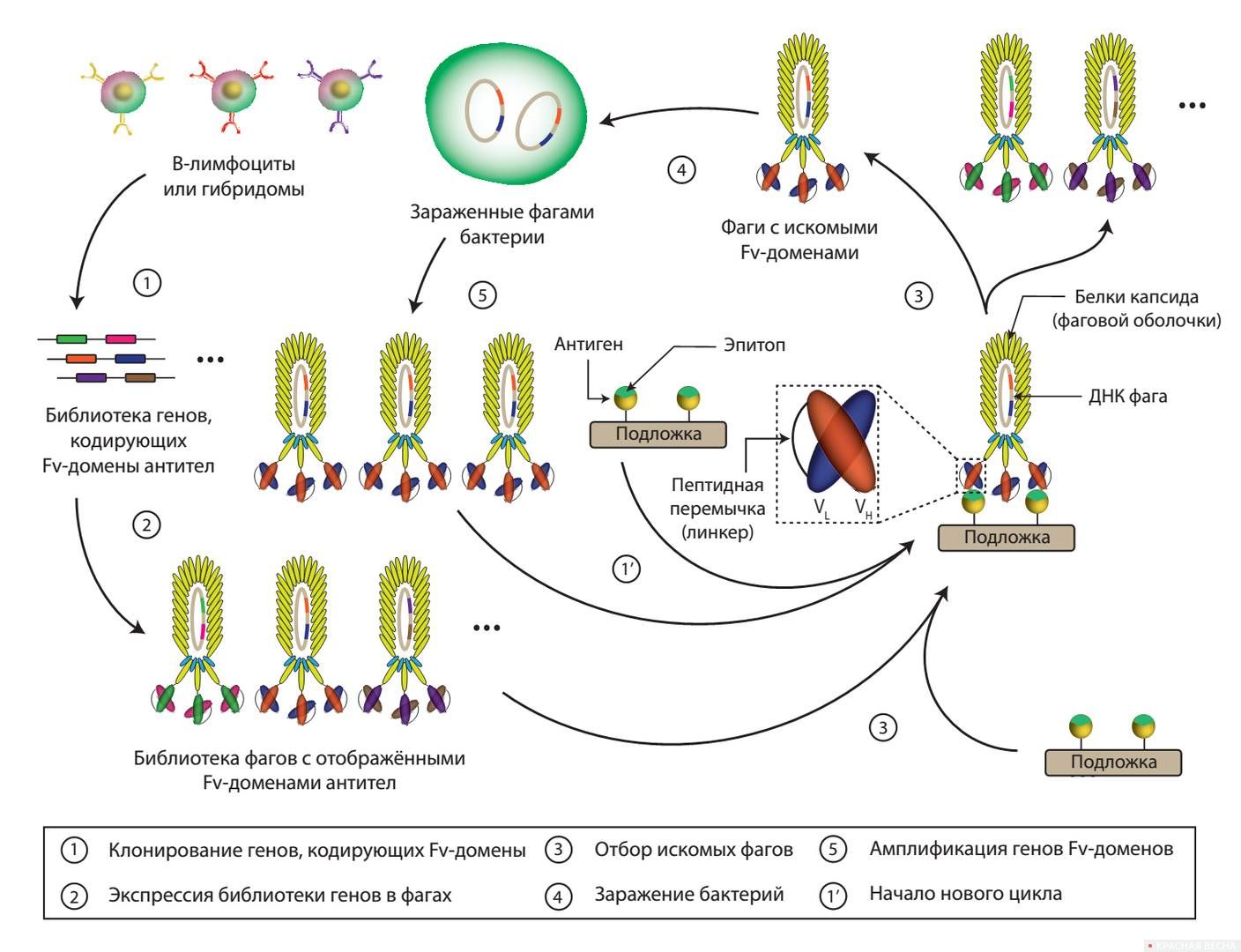
Наконец, англичанин Грегори Винтер в 1994 году адаптировал технологию фагового дисплея для широкомасштабного производства иммунологических препаратов. Антитела ко многим белкам, полученные по этой методике, применяются как лекарства против онкологических и аутоиммунных заболеваний, а также как антидоты для нейтрализации белковых токсинов.
Напомним, что днем ранее, 2 октября 2018 года, Нобелевский комитет удостоил той же награды Артура Эшкена (США), Жерара Мура (Франция) и Донну Стриклэнд (Канада) «за прорывные исследования в области лазерной физики».
Напомним также, что Нобелевская премия по физиологии и медицине за 2018 год была присуждена за прорывные исследования в области онкологии. Лауреатами стали японец Тасуку Хондзё и американец Джеймс Элисон. Оба ученых стояли у истоков иммунотерапии злокачественных опухолей и первыми предложили лечить рак с помощью антител.
Винтера, Смита, а отчасти и Арнольд можно назвать «крестными отцами» направленной иммунотерапии даже c большим правом, чем Хондзё и Элисона, которым вручили Нобелевскую премию по физиологии и медицине двумя днями раньше. В самом деле, «физиологи», когда подбирали антитела (иммуноглобулины) к онкорецепторам, пользовались технологиями «химиков» — в частности, методикой фагового дисплея.
Впрочем, специфичные иммуноглобулины к индивидуальным белкам умели получать и раньше. Всё началось с пионерских изысканий Георга Кёлера и и Сезара Мильштейна, которые в 1975 году предложили так называемую гибридомную технологию. Эта методика впервые позволила получить антитела с заданной специфичностью и предсказуемым сродством к мишени — так называемые моноклональные антитела.
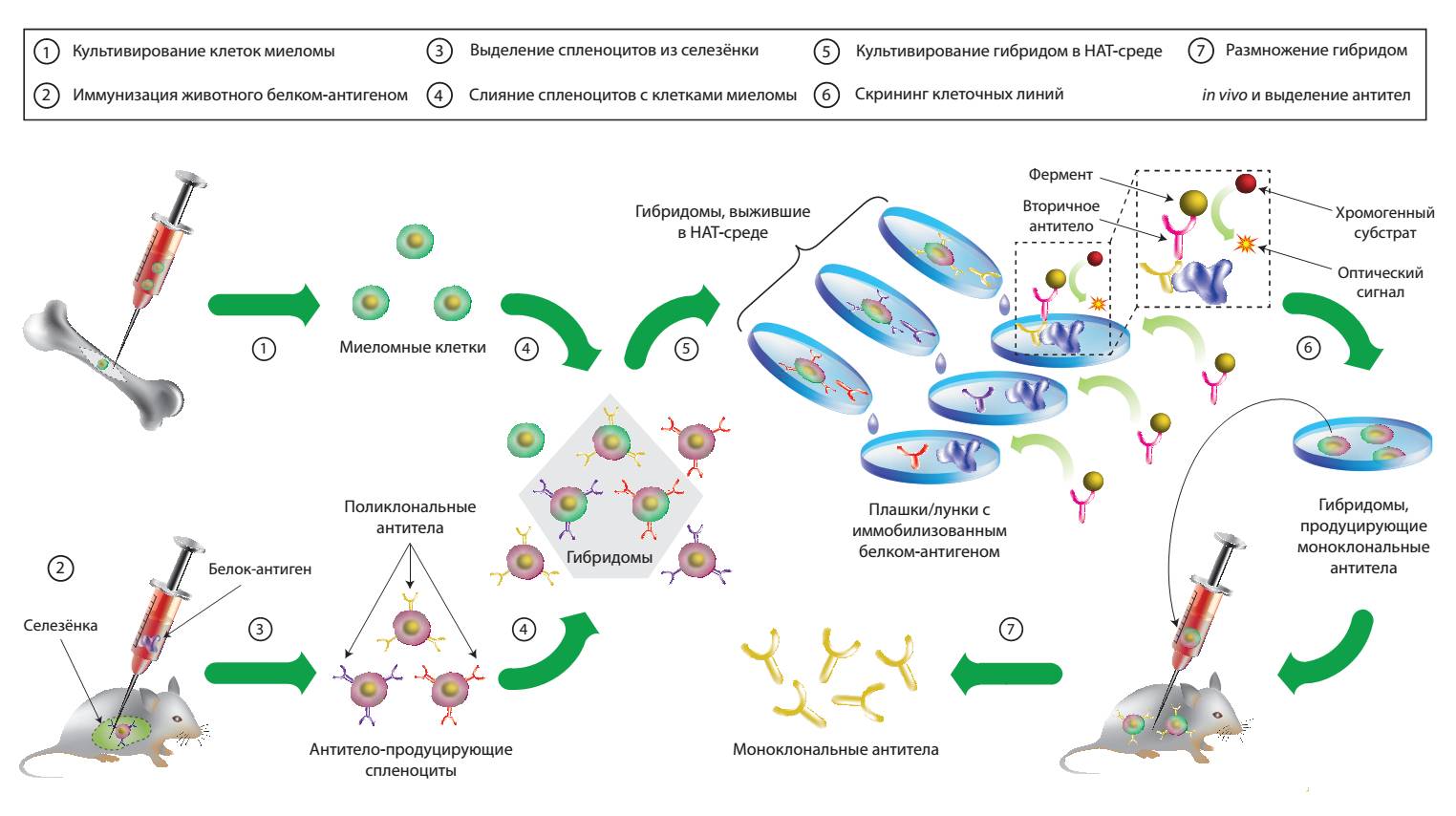
Однако по методике Кёлера и Мильштейна антитела приходилось нарабатывать в организме лабораторных мышей. Мышиные иммуноглобулины отличаются от человеческих слишком сильно, чтобы использовать их в лечебных целях без риска спровоцировать иммунный ответ.
Именно поэтому терапевтические антитела, если не считать муромонаб-CD3 от компании Johnson & Johnson, вплоть до середины 1990-х гг. не выходили за пределы лабораторий. Шквальное их внедрение в клиническую практику началось лишь после того, как Винтер сумел реализовать на практике технологию фагового дисплея. Учитывая, что сейчас препараты на основе моноклональных антител составляют около 1/3 всех производимых декарств, можно констатировать, что открытия Винтера и Смита произвели подлинный переворот в фармакологии.














