Японские ученые раскрыли механизм регуляции распределения центромер клетки
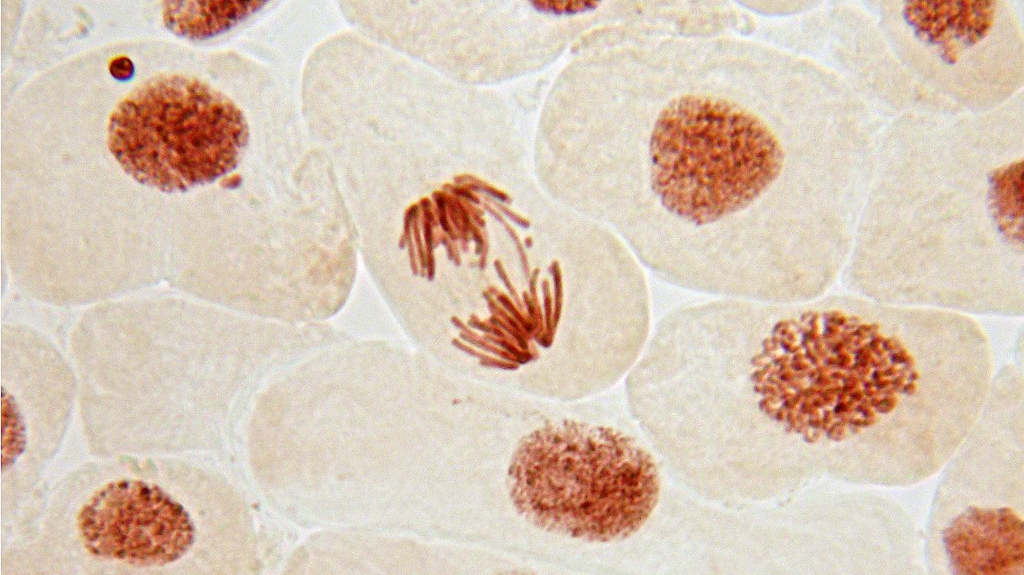
Двухэтапный механизм, регулирующий распределение центромер при делении клетки, предложили ученые из Токийского университета, сообщает 2 августа пресс-служба учебного заведения.
Исследование японских ученых также предполагает, что конфигурация центромер в ядре играет роль в поддержании целостности генома. Результаты работы были опубликованы в журнале Nature Plants.
При делении клетки в ее противоположные концы устремляются особые хромосомные домены — центромеры. После того как ядро новой клетки сформируется, центромеры распределяются в ядре.
При этом, если центромеры так и останутся у полюса новой клетки, то есть с одной стороны ее ядра, такую неравномерную конфигурацию называют Rabl (в честь цитолога XIX века Карла Рабля). Если же центромеры распределяются в клетке более равномерно, то конфигурация будет называться не-Rabl.
Автор исследования профессор Токийского университета Сатихиро Мацунага рассказал: «Биологическая функция и молекулярный механизм конфигурации Rabl или не-Rabl были загадкой на протяжении веков. Мы успешно раскрыли молекулярный механизм построения конфигурации, отличной от Rabl».
Исследователи изучали растение кресс-салат (Arabidopsis thaliana), образец, не имеющий конфигурации Rabl, и его мутантную форму с конфигурацией Rabl, и обнаружили, что белковые комплексы, известные как конденсин II (CII), и белковые комплексы, известные как линкер комплекса нуклеоскелета и котоскелета (LINC), работают вместе, определяя распределение центромер во время клеточного деления.
«Распределение центромер для конфигурации, отличной от Rabl, регулируется независимо комплексом CII-LINC и белком ядерной пластинки, известным как CROWDED NUCLEI (CRWN)», — заявил Мацунага.
В этом двухступенчатом регуляторном механизме распределения центромер, который обнаружили исследователи, комплекс CII-LINC определяет рассеяние центромер от поздней анафазы к телофазе — двух фаз в конце клеточного деления. На втором этапе CRWN стабилизируют рассеянные центромеры на ядерной пластинке внутри ядра.
Чтобы понять биологическую значимость этих процессов, исследователи проанализировали экспрессию генов A. thaliana и его мутанта со структурой Rabl. Так как изменение пространственного расположения центромер меняет и пространственное расположение генов, исследователи считали, что у них будут различия в экспрессии генов, но это казалось не так. Однако, при стрессе повреждения ДНК, органы мутанта росли медленнее, чем у нормального растения.
«Это говорит о том, что точный контроль пространственного расположения центромер необходим для роста органов в ответ на стресс повреждения ДНК, и нет никакой разницы в толерантности к стрессу повреждения ДНК между организмами с Rabl и без Rabl», — пояснил Мацунага.
Таким образом, независимо от конфигурации Rabl, соответствующее пространственное расположение ДНК в ядре важно для реакции на стресс, отметил ученый.
Мацунага заявил, что следующие шаги исследователей будут направлены на выявление источника энергии, изменяющего пространственное расположение определенных участков ДНК, и механизма, который распознает конкретную ДНК.
«Подобные открытия приведут к разработке технологии искусственного расположения ДНК в ядре клетки», — сказал ученый. Такая технология позволит создавать стрессоустойчивые организмы и придавать им новые свойства и функции за счет изменения пространственного расположения ДНК, а не редактирования ее нуклеотидной последовательности, считают исследователи.












