Лазерные «сверла», антитела против рака, старинная вакцина и кое-что еще

Сила света в действии: лазерные «пинцеты» и «сверла»
Все последние дни научное сообщество пристально следило за главным событием года — вручением Нобелевской премии в нескольких областях. Одна из интриг разрешилась 2 октября, когда наградили физиков. Лауреатами стали трое коллег-лазерщиков: Артур Эшкен из США, Жерар Мур из Франции и Донна Стриклэнд из Канады.
Артур Эшкен — признанный корифей лазерной физики. Прошло уже 40 лет с тех пор, как ученый воплотил мечту свой юности: заставить лучи лазера захватывать и перемещать микроскопические частицы. Еще в 1978 году он изобрел оптический «пинцет», с помощью которого можно манипулировать нано- (атомы, вирусы) и микрообъектами (бактерии, живые клетки).
Внутри частицы, стоит ей попасть в электрическое поле лазерного пучка, нарушается распределение заряда и возникает так называемый дипольный момент. Чтобы скомпенсировать этот момент, частица меняет положение в пространстве, пока не сориентируется по градиенту поля. Если правильно сфокусировать лазерный пучок, то частицу можно захватить и перетащить на произвольное расстояние.
Жерар Мур и Донна Стриклэнд отметились изысканиями в смежной области. Ученые в 1985 году разработали «метод генерирования ультракоротких оптических импульсов высокой интенсивности». Фемтосекундные (1 фемтосекунда = 10-15 с) лазеры, в которых реализована эта технология, испускают сверхкороткие импульсы, что позволяет с предельной аккуратностью «высверливать» микроотверстия в любом материале.

Первыми, кому пригодилось открытие Мура и Стриклэнд, оказались микрохирурги-офтальмологи. Специалисты знают: перед тем как проводить лазерную коррекцию зрения, требуется расслоить ткань роговицы. Наносекундные (1 наносекунда = 10-9 с) не справлялись со столь тонкой работой, из-за чего роговичный лоскут приходилось формировать механически — с помощью так называемого кератома. С приходом в офтальмологию фемтосекундных лазеров в начале 2000-х гг. задача существенно упростилась. Вот уж действительно — идея нашла не худшее воплощение!
20 лет ожидания: первопроходцев антираковой иммунотерапии наконец-то отметили
За день до этого, 1 октября, вручалась Нобелевская премия по медицине. В этой сфере престижнейшей награды удостоились японец Тасуку Хондзё и американец Джеймс Элисон, с именами которых неразрывно связано новейшее направление в онкологии — иммунотерапия с помощью антител.
Элисон многие годы занимался CTLA-4 — одним из поверхностных белков T-лимфоцитов, которые распознают и уничтожают «подозрительные» клетки. Повышенная выработка CTLA-4 при онкологических заболеваниях «ослепляет» T-лимфоциты и лишает их возможности атаковать раковые клетки.
Элисон с коллегами в 1996 году разработали антитело к CTLA-4 (ипилимумаб), которое отчасти возвращает T-лимфоцитам эту способность. Клинические испытания 2010 года показали, что блокада CTLA-4 эффективна у пациентов с раком кожи (меланомой). С 2011 года ипилимумаб продается в виде лекарства под торговой маркой Yervoy по всему миру.
Хондзё независимо от Элисона в 1992 году открыл белок PD-1 (англ. Programmed cell Death protein-1), который, как и CTLA-4, тоже «отвлекает» T-лимфоциты от борьбы с раковыми клетками. Антитело против PD-1 — ниволумаб — оказалось настолько эффективно, что иногда приводило к стойкой ремиссии даже у безнадежных пациентов с множественными метастазами. С 2014 года оно продается под торговой маркой Opdivo.
Видные фармакологи давно сходились во мнении, что Хондзё и Элисон рано или поздно удостоятся Нобелевской премии за свои прорывные разработки. И вправду, как было обойти вниманием тех, кто стоял у истоков целого направления в онкологии? Сейчас антитела к «онкобелкам» помогают миллионам пациентов если не полностью вылечиться от рака, то хотя бы избежать ужасных последствий химиотерапии. Впрочем, антираковая иммунотерапия еще далеко не исчерпала своих возможностей, которые простираются гораздо дальше сегодняшних. И всё это — благодаря пионерским изысканиям новоиспеченных лауреатов.
«Медики» предполагают, «химики» располагают
Впрочем, Хондзё и Элисон нуждались в условных «коллегах», чтобы те придумали, как получать пресловутые антитела. Символично, что бойцы прикладного и фундаментального фронтов разделили радость триумфа почти одновременно: 3 октября лауреатами Нобелевской премии по химии стали американец Джорж Смит и британец Грегори Винтер вместе с еще одной уроженкой США Фрэнсис Арнольд.
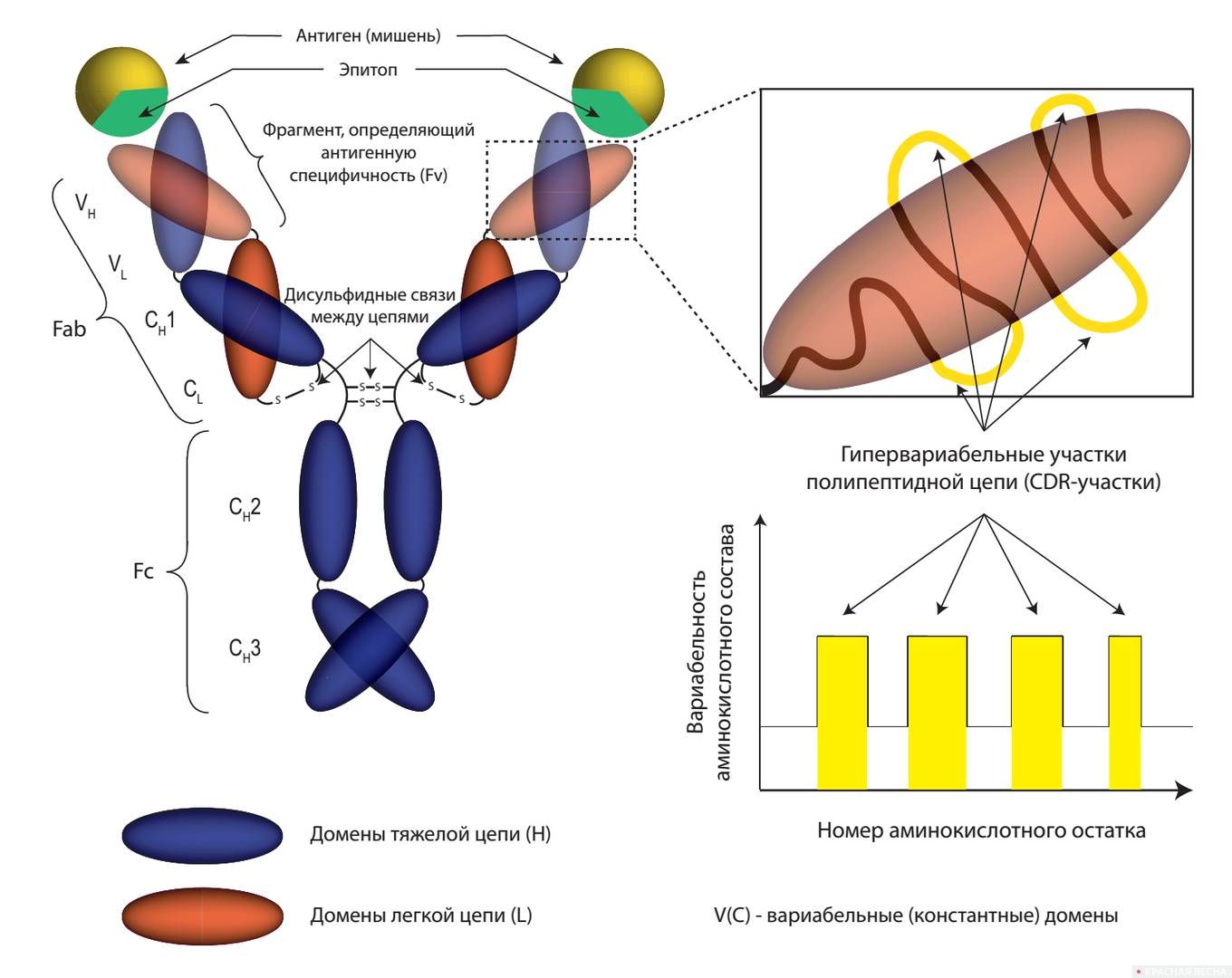
Впрочем, антитела к отдельным белкам-мишеням умели получать задолго до Смита и Винтера. Ещё в 1975 году Георг Кёлер и Сезар Мильштейн предложили гибридомную технологию, которая впервые позволила получать антитела с заданной специфичностью и предсказуемым сродством к мишени — так называемые моноклональные антитела. Однако по методике Кёлера и Мильштейна их приходилось нарабатывать в организме лабораторных мышей, а мышиные антитела отличаются от человеческих слишком сильно, чтобы использовать их в лечебных целях.
Эту проблему и начал решать Джордж Смит, который в 1985 году предложил технологию фагового дисплея. Этот изящный метод позволяет подбирать человеческие антитела практически к любым белкам с помощью фагов — специальных вирусов, поражающих бактерии.
Для фагового дисплея нужна библиотека генов, кодирующих всевозможные варианты человеческих антител. После встраивания этой библиотеки в геном вируса соответствующие антитела отображаются (англ. display) на фаговой оболочке. Из них, в свою очередь, отбирают те, которые свяжутся с белком-мишенью. Чтобы достичь нужной степени «обогащения», процедуру повторяют несколько раз. В каком-то смысле процесс подобен естественному отбору в дикой природе: с каждым новым циклом библиотека всё больше обогащается «сильнейшими» антителами, пока «слабейшие» полностью не отсеются.

Однако эту технологию еще нужно было адаптировать для широкомасштабного производства терапевтических антител, что и сделал Грегори Винтер в 1994 году. Стоило этому случиться, как они стали разрабатываться и внедряться в клиническую практику одно за другим. Этот бум весьма удачно совпал с изысканиями Хондзё и Элисона. И всё-таки пути научных открытий неисповедимы!
Старинная вакцина против рака вынырнула из тьмы десятилетий. Ждать ли «камбэка»?
Продолжая тему противораковых изысканий, нельзя не отметить ещё одно любопытное исследование, о котором 1 октября написал научный портал Science. На этот раз отметились американские ученые из университета Техаса.
Американские фармакологи испытывали на онкобольных клостридии (Clostridium novyi) — спорообразующие микроорганизмы, которые вызывают газовую гангрену и сепсис. Чтобы у испытуемых не развились эти опасные состояния, у бактерий предварительно «отключали» ген, кодирующий клостридиальный токсин. У 19 из 23 добровольцев, которым впрыскивали споры C. novyi в опухоль, прекращала расти не только она сама, но и ее метастазы по всему организму.

Антираковый эффект сопровождался типичными симптомами инфекции — жаром, лихорадкой и местной болью. По всей видимости, иммунная система, мобилизованная на борьбу с болезнетворными микроорганизмами, заодно начинает «съедать» и раковые клетки.
Изыскания фармакологов из Техаса отсылают к противораковой вакцине Коли — исторически первому, но основательно подзабытому способу лечения рака. Американский онколог Вильям Коли еще в 1890-х гг. пробовал впрыскивать пациентам с неоперабельной саркомой убитые бактерии Streptococcus pyogenes и Serratia marcescens, что вызывало иммунный ответ и сопровождалось стабилизацией или даже рассасыванием опухоли.
Эффективность вакцины Коли ошеломляет даже сегодня. В 1999 году исследователи подняли архивы и обомлели: среди вакцинированных женщин, больных неоперабельным раком груди, выживало... 65%! Даже весь комплекс современных методик спасает лишь каждую пятую пациентку с таким диагнозом!
Однако в 1960-х гг. эту «чудо-вакцину» сняли с производства. Почему? По официальной версии, она не выдержала конкуренции с химиотерапией и лучевой терапией — двумя «китами», на которых зиждилась онкология все последние десятилетия, пока стараниями Хондзё и Элисона к ним не добавился третий. Однако тут вряд ли обошлось без «акул» фармацевтического бизнеса, которые тогда еще только начинали бороздить рыночные просторы.
Эксперименты с клостридиями могли бы дать робкие надежды на возрождение направления, тем более что это не первое исследование такого рода за последние годы. Впрочем, потеснить c многомиллиардного рынка химиопрепараты и антитела бактериальной противораковой вакцине будет еще труднее, чем полвека назад, поэтому шансы на «камбэк» невелики.
«Молекулярные ножницы» всё вырежут сами? CRISPR-Cas9 против смертельного недуга
Прибавилось на этой неделе надежды и у больных миодистрофией Дюшенна. У мальчиков с этим недугом нарушается выработка белка дистрофина, из-за чего у них постепенно отказывают мышцы, пока атрофия сердечной и дыхательной мускулатуры не приведет к смерти. Американским ученым удалось частично восстановить выработку дистрофина с помощью «молекулярных ножниц» — системы редактирования генома CRISPR-Cas9. Соответствующая статья опубликована в журнале Science от 5 октября.
Эксперименты проводились на собаках с теми же мутациями в гене дистрофина, что и у большинства больных миодистрофией Дюшенна. Белковые компоненты системы CRISPR-Cas9 доставлялись в организм животных с помощью аденовируса по отработанной схеме.
Через 6 недель ученые проверили, насколько у собак восстановилась выработка нормального, немутантного дистрофина. При доставке непосредственно в мышцу уровень белка в ней вырастал до 60% от нормы, тогда как при инъекции в глазное дно эффект проявлялся неравномерно. Так, например, в бицепсах выработка дистрофина восстанавливалась на 64%, в диафрагме — на 58%, а в трицепсах — на четверть. Примечательно, что в сердечной мышце уровень белка нормализовался почти полностью. Почти везде выработка дистрофина сопровождалась регенерацией мышечной микроструктуры.
Подсчитано, что миодистрофия Дюшенна перестает прогрессировать, если восстановить выработку немутантного дистрофина до 15% от нормы. Однако существующие методы лечения, увы, поднимают уровень заветного белка всего на доли процента.
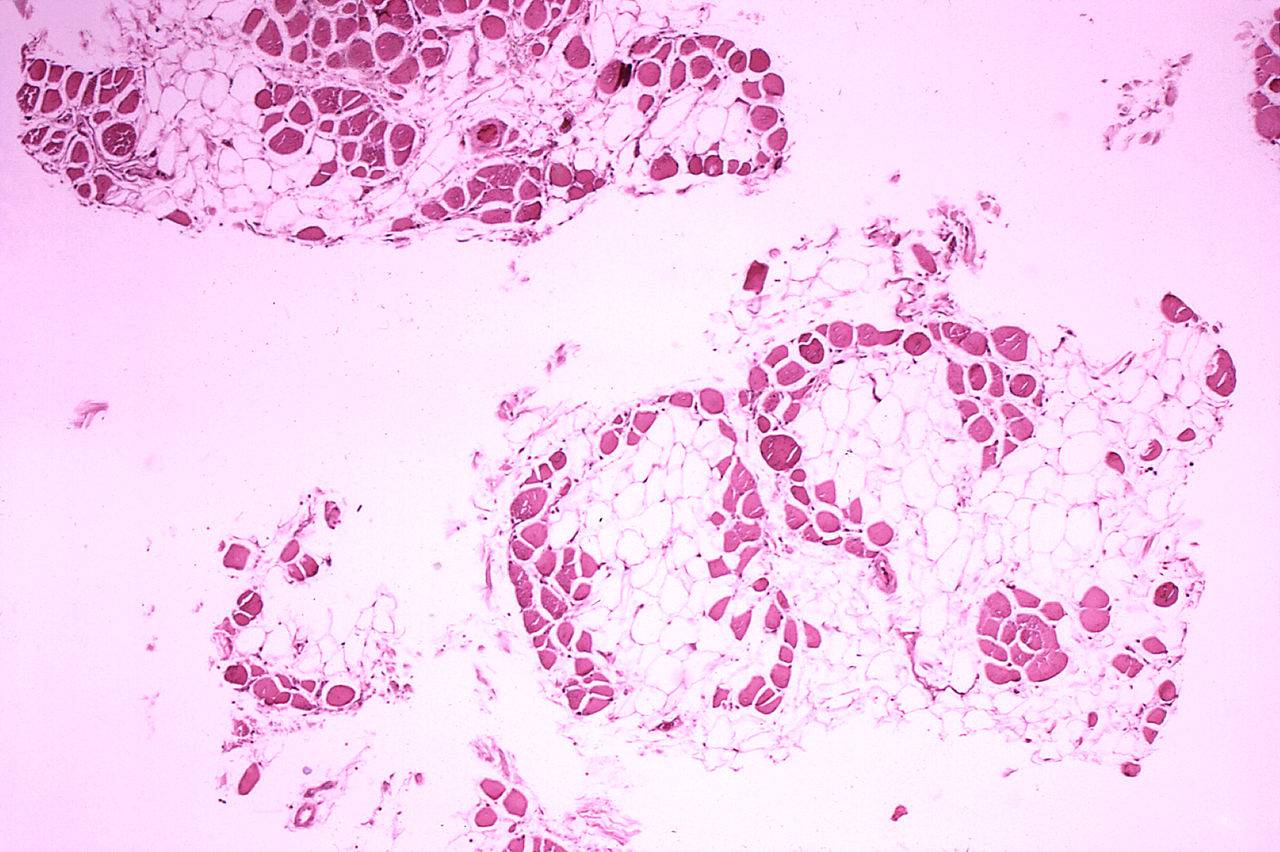
Казалось бы, вооружившись «молекулярными ножницами», ничего не стоит играючи взять этот 15%-ный барьер. Однако радоваться еще рано: за 6 недель эксперимента невозможно понять, не «режут» ли они геном в других местах, приводя к непредсказуемым последствиям. Поэтому переход от испытаний на мышах и собаках к лечению людей пока остается под большим вопросом.

















